http://www.ise.polsl.pl/strony/czasowe/powtorka_z_chemii/ustalanie%20wzorow%20czasteczkowych%20zwiazkow%20organicznych.doc
P.2 Ustalanie wzorów cząsteczkowych związków organicznych
Ustalania wzorów związków chemicznych sprowadza się do ustalenia stosunku molowego w jakim łączą się pierwiastki w cząsteczce. Taka forma podania wzoru nosi nazwę wzoru empirycznego, który łatwo przekształcić w rzeczywisty z chwilą, gdy znamy masę molową badanego związku. Tak więc proszę na początek utrwalić sobie istotę pojęć wzór empiryczny(wówczas gdy nie znamy masy molowe) i wzór rzeczywisty do ustalenia którego niezbędna jest znajomość masy molowej.
A/ Wzór związku chemicznego najprościej ustalić na podstawie znajomości stosunku masowego w jakim łączą się pierwiastki w danym związku. W zadaniach stosunki wagowe podaje się na kilka sposobów:
Przez bezpośrednie podanie stosunku masowego pierwiastków tworzących związek
Przez podanie składu procentowego badanego związku
Przez podanie masy produktów powstałych w wyniku spalenia próbki związku, najczęściej z określeniem masy spalonej próbki
W kolejnym etapie następuje przekształcenie stosunku wagowego w stosunek molowy, który stanowi bezpośrednią podstawę ustalenia wzoru.
B/ Wzór można również ustalić na podstawie znajomości parametrów niektórych reakcji badanego związku np. reakcji spalania
Jeżeli chodzi o masę molową, to często podawana jest bezpośrednio, lecz gdy badanym związkiem jest gaz, podaje się czasami jedynie jego gęstość wyrażoną w g/dm3 w warunkach normalnych. W tej sytuacji korzystamy z faktu, że mol gazu w warunkach normalnych ma objętość 22,4 dm3. Oczywiście istnieją również inne sposoby pośredniego określenia stosunków wagowych lub masy molowej, sądzę jednak, że rozwiązanie przykładów ze zbioru zadań i zestawów testów maturalnych pozwoli te obliczenia zrozumieć i opanować w zadawalającym stopniu.
Przykłady zadań z testów maturalnych
Do spalenia 40 cm3 gazowego węglowodoru zużyto 100 cm3 tlenu. Otrzymano 80 cm3 tlenku węgla(IV) oraz parę wodną. Objętości mierzono w tych samych warunkach ciśnienia i temperatury. Ustal wzór sumaryczny i nazwę badanego związku
Próbkę związku organicznego o masie 3,7 g spalono całkowicie. Otrzymano 3,36 dm3 tlenku węgla(IV), mierzonego w warunkach normalnych, oraz 2,7 g wody. Ustal wzór elementarny, będący jednocześnie wzorem rzeczywistym tego związku.
Spalono 2,2 g alkoholu o masie molowej 88 g/mol i otrzymano 5,5 g CO2 i 2,7 g H2O Ustal wzór sumaryczny tego związku.
Po spaleniu 11,2 g pewnego związku otrzymano 26,4 g tlenku węgla(IV) i 7,2 g wody. Badana substancja redukowała wodorotlenek miedzi(II) oraz odbarwiała wodę bromową. Stwierdzono, że jeden mol badanej substancji może przyłączyć jeden mol bromu. Dokonując odpowiednich obliczeń i korzystając z podanych informacji podaj wzór grupowy badanej substancji.
Pewna uwodniona sól zawiera 23,28% wapnia, 18,62% siarki, 55,75% tlenu oraz 2,34% wodoru. Jaki jest wzór tej soli ?
Stosunek mas cząsteczkowych dwóch n-alkanów będących kolejnymi homologami jest równy 1,318. Ustal wzory sumaryczne i podaj nazwy tych związków.
Podaj wzór i nazwę związku wiedząc, że jego gęstość wynosi 1,339 g/dm3 a stosunek masowy C:H= 4:1
10 cm3 pewnego nienasyconego węglowodoru zmieszano z 70 cm3 tlenu i mieszaninę zapalono za pomocą iskry elektrycznej. Po zakończeniu reakcji i skropleniu pary wodnej objętość gazów wynosiła 50 cm3 a po przepuszczeniu przez roztwór wodorotlenku potasu zmniejszyła się do 10 cm3. Jaki węglowodór spalono ?
W wyniku spalenia 2,12 mg pewnego węglowodoru o masie cząsteczkowej 106 u otrzymano 7,04 mg dwutlenku węgla i 1,80 mg wody. Badany węglowodór reaguje z chlorem zarówno w obecności chlorku żelaza(III) jak i światła. Jaki to węglowodór ?
Dwa różne związki organiczne mają jednakowy skład procentowy: 40,01% C, 6,66% H i 53,33% tlenu. Masy cząsteczkowe tych substancji wynoszą odpowiednio 30 u oraz 60 u. Ustal wzory cząsteczkowe tych związków oraz podaj ich nazwy.
W wyniku spalenia 1,86 g związku otrzymano 2,64 g CO2 oraz 1,62 g H2O Jaki związek spalono, jeżeli wiadomo, że jego wzór rzeczywisty jest dwukrotnością wzoru elementarnego.
Rozwiązania zadań z testów maturalnych
Zad.1
Ze względu na równość objętości molowych gazów, podane objętości można potraktować jako współczynniki równania reakcji, które można zapisać w formie ogólnej a następnie stopniowo uzgadniać dochodząc w efekcie do wzoru cząsteczkowego spalanego węglowodoru, którego wzór wyjściowy zapiszemy ogólnie jako
CH: 40 CH + 100 O2= 80CO2 + H2O.
Tak zapisane współczynniki uprościmy dzieląc je przez 40, otrzymujemy wówczas:
CH +2,5O2 = 2CO2 + H2O
Dwa mole powstałego CO2 oznaczają, że w molu węglowodoru znajdują się dwa mole atomów węgla, następnie uzgadniamy ilość tlenu, którego po stronie produktów mamy 2,5 mola co znaczy, że powstał jeden mol wody a więc w cząsteczce węglowodoru znajdują się dwa atomy wodoru. Prawidłowy zapis równania spalania całkowitego tego węglowodoru ma postać:
C2H2 + 2,5O2 = 2CO2 + H2O.
Spalanym węglowodorem był etyn znany również pod nazwą zwyczajową acetylen, rozpoczynający szereg homologiczny alkinów.
Zad.2
Jako, że nie mamy informacji o składzie jakościowym spalanego związku, policzymy z ilości podanych produktów spalania zawartość węgla i wodoru w spalanej próbce a następnie z porównania mas obliczymy ewentualną zawartość tlenu.
1 mol CO2 czyli 22,4 dm3 zawiera 12 g węgla
3,36 dm3 zawiera x g węgla x = 1,8 g węgla
1 mol H2O czyli 18 g zawiera 2 g wodoru
2,7 g zawiera x g wodoru x = 0,3 g wodoru
łączna masa węgla i wodoru 2,1g, dopełnienie do masy spalonej próbki stanowi tlen, którego jest (3,7g - 2,1g) = 1,6 g tlenu
Stosunek wagowy pierwiastków wynosi więc- mC : mH : mO = 1,8:2,1:1,6 Następnie obliczamy stosunek molowy składników: 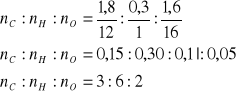
Wzór sumaryczny badanego związku C2H6O2, uwzględniając charakterystyczne grupy połączeń organicznych można przyjąć, że związek ten jest kwasem karboksylowym o wzorze C2H5COOH- kwas propionowy. Jednak kwasy karboksylowe są izomerami funkcjonalnymi estrów kwasów karboksylowych. Mając na uwadze ilość atomów węgla izomerem jest mrówczan etylu: HCOOC2H5.
Zad.3
Skoro spalanym związkiem jest alkohol, więc składa się z węgla, wodoru i tlenu, którego ilość obliczymy z różnicy masy spalanej próbki i wyliczonych ilości węgla(z CO2) i wodoru (zH2O)
1 mol CO2 w 44g znajduje się 12 g węgla
5,5 g znajduje się x g węgla x = 1,5 g węgla
1 mol H2O 18 g znajdują się 2g wodoru
2,7 g znajduje się x g wodoru x = 0,3 g wodoru
masa tlenu 2,2 g próbki - 1,5 g węgla - 0,3 g wodoru = 0,4 g tlenu
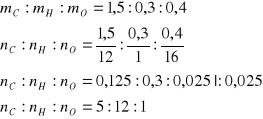
Wzór sumaryczny badanego alkoholu C5H11OH
Zad.4
Z podanych informacji obliczymy stosunek wagowy pierwiastków w badanym związku:
Ilość węgla:
1 mol CO2 czyli 44 g CO2 zawierają 12 g węgla
26,4 g CO2 zawiera x g węgla x = 7,2 g węgla
1 mol H2O czyli 18 g H2O zawiera 2 g wodoru
7,2 g H2O zawiera x g wodoru x = 0,8 g wodoru
Obliczamy ilość tlenu m = 11,2 g związku - 7,2 g węgla - 0,8 g wodoru = 3,2 g węgla
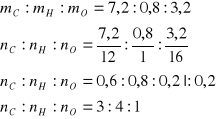
Wzór sumaryczny tego połączenia C3H4O, dalsze informacje wskazują, że w cząsteczce tego związku znajduje się jedno podwójne wiązanie(1 mol bromu) oraz grupa aldehydowa (redukcja tlenku miedzi(II) - próba Trommera) - C2H3CHO: półstrukturalnie: H2C=CH-CHO
Zad.5
Zadanie dotyczy wprawdzie substancji nieorganicznej jednak pokażę sposób jego liczenia ze względu na specyfikę, gdyż cząsteczkę buduje kilka różnych pierwiastków. Podano skład procentowy związku. Załóżmy więc, że mamy 100g substancji wówczas 1% odpowiada 1g, tak więc stosunek wagowy składników można przedstawić:
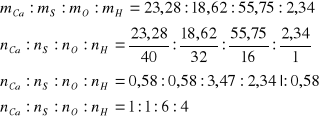
zgodnie z informacją jest to sól uwodniona, czyli cała ilość wodoru pochodzi z wody, będą to dwa mole wody. Pozostają cztery mole tlenu atomowego, tak więc wzór badanej soli to CaSO4•2H2O jest to dwuwodny siarczan(VI) wapnia znany pod nazwą zwyczajową gips.
Zad.6
Dwa kolejne homologi szeregu homologicznego różnią się o tzw. różnicę homologiczną, którą jest grupa metylenowa CH2. Tak więc jeżeli masa pierwszego związku jest równa M to kolejnego będzie wynosiła (M +14), czyli będzie większa o masę tzw. różnicy homologicznej. Zgodnie z treścią zadania:![]()
tak więc po przekształceniu 0,318 M = 14; M=44. Zgodnie z treścią zadania mamy do czynienia z alkanami, których wzór ogólny jest równy CnH2n+2. Podstawiając odpowiednie masy atomowe otrzymujemy kolejne równanie: 12n+2n+2=44, po dalszych obliczeniach 14n = 42 i dalej n = 3, tak pierwszy ze związków to propan a drugi, to kolejny w szeregu homologicznym alkanów, butan.
Zad.7
Wiedząc, że gęstość związku w warunkach normalnych wynosi 1,318 g/dm3 można obliczyć masę molową M = 22,4 dm3•1,339 g/dm3 = 30 g/mol, wiedząc z kolei że stosunek wagowy pierwiastków ma się mC:mH= 4:1, można policzyć ile razy ta masa jednostkowa (4+1) mieści się w masie molowej, czyli 30:5 = 6, tak więc mC:mH = 24 : 6, co odpowiada odpowiednio dwom atomom węgla i sześciu atomom wodoru. Tak więc badany związek to C2H6 - etan
Zad.8
W zadaniu podano objętości substratów, które posłużą do ułożenia równania reakcji i dalej wzoru węglowodoru, o którym wiadomo, że jest nienasycony.
Objętość węglowodoru - 10 cm3
Objętość tlenu - (70 cm3 - 10 cm3) = 60 cm3
Objętość CO2, gdyż został pochłonięty przez roztwór wodorotlenku-(50cm3-10 cm3)= 40cm3. Teraz można przystąpić do zapisania równania reakcji spalania:
10CH + 60 O2=40CO2 + H2O
Uzgodnienie powyższego równania doprowadzi je do postaci:
C4H8 + 6O2 = 4CO2 + 4H2O
Spalonym węglowodorem był prawdopodobnie butyn lub cyklobutan
Zad.9
W zadaniu jako jednostkę masy zastosowano miligramy, jednak ze względów praktycznych można przejść na gramy. Następnie obliczmy ile razy taka odważka mieści się w jednym molu 106 : 2,12 = 50. Ze spalenia mola substancji otrzymanoby więc 50x7,04 =352g czyli 8 moli z czego wynika, że mol badanego związku zawiera 8 atomów węgla. Następnie policzmy ilość wodoru 50 x 1,80 = 90 g wody czyli 5 moli z czego wynika, że cząsteczka związku zawiera 10 atomów wodoru. Tak więc wzór węglowodoru C8H10. Dalsza informacja zawarta w zadaniu wskazuje, że badany związek to jeden z możliwych ksylenów czyli dimetylobenzenów C6H4(CH3)2 lub etylobenzen C6H5C2H5
Zad. 10
Ustalamy wzór empiryczny związku o znanym składzie procentowym co umożliwia ustalenie stosunku wagowego a następnie molowego pierwiastków tworzących cząsteczkę
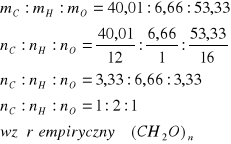
Znając masy cząsteczkowe dwóch związków można ustalić ich wzory rzeczywiste dla pierwszego HCHO a dla drugiego CH3COOH, są to więc kolejno aldehyd mrówkowy (metanal) i kwas octowy (etanowy)
Zad.11
Ilość węgla i wodoru w spalonej próbce
1 mol czyli 44 g CO2 zawiera 12 g węgla
2,64 g CO2 zawiera x g węgla x = 0,72 g węgla
1mol czyli 18 g H2O zawiera 2 g wodoru
1,62 g H2O zawiera x g wodoru x = 0,18 g wodoru
ilość tlenu m = 1,86 g - (0,72 +0,18) x = 0,96 g tlenu
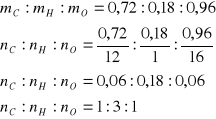
wzór empiryczny (CH3O)n zgodnie z informacją zawartą w zadaniu wzór rzeczywisty jest dwukrotnością wzoru empirycznego czyli C2H6O2, związkiem tym może więc być przykładowo glikol etylenowy C2H4(OH)2
1
Wyszukiwarka