P1050734
S. POLAROGRAFIA, WOLTAMPEROMETRIA I AMPEROMETRIA 326
półfali nie zależy od stężenia, w przeciwieństwie do potencjału wydzielania (potencjał wydzielania na KER jest to potencjał elektryczny, przy którym zaczyna się efektywny przebieg reakcji elektrodowej depolaryzatorów — patrz p. 4.1.7). Rysunek 5.12 przedstawia w sposób graficzny różnice między potencjałem wydzielania danego składnika o różnych stężeniach a potencjałem półfali, który nie ulega zmianie.
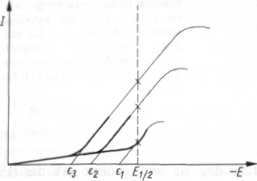
Rys. 5.12
Krzywe polarograficzne roztworów tego samego depolaryzatora o różnych stężeniach; e2, e3 — potencjały wydzielania depolaryzatora, El/2 — potencjał półfali
Potencjał półfali zależy w dużym stopniu od składu roztworu^ (szczególnie. od pbecnośc^^c^nników^tompleksuiacyełr-oraz pH) Znaczenie składu roztworu można ocenie, porównując np. dane dla ołowiu i kadmu. Kationy te w 1 mol/1 NaOH mają identyczne potencjały półfali — 0,76 V (względem NEK), natomiast dość dobrze są rozdzielone w 1 mol/1 KC1 — 0,64 V dla kadmu(II) i -0,44 V dla ołowiu(II), a jeszcze lepiej w 1 mol/1 KCN, odpowiednio — 1,18 V i -0,72 V.
W przypadku obecności kilku jonów w roztworze, potencjały półfali pozwalają przewidzieć, czy otrzyma się dla każdego z nich oddzielną fazę (różnice potencjałów półfali dostatecznie duże), czy też jedną falę (potencjały półfali bardzo bliskie). Wiązanie jonu w kompleks powoduje zmianę potencjału półfali jonu kompleksowego w stosunku do jonu prostego. Po wprowadzeniu odczynnika komplek-sującego zachodzi reakcja kompleksowania jonów metalu
M"++pL“ -MLJ-'
W wyniku reakcji tworzy się jeden trwały kompleks. Zachodzące podczas elektrolizy reakcje dla jonu prostego i kompleksowego B
Wyszukiwarka