Samsung SCX 6x22 Series 091118164909 1


Rys.1.2. Zmiany anergll w czasie biegu reakcji egzotermicznej s
a) bez udziału katalizatora} b) z udziałem katalizatora
Schematycznie, zmiany energii aktywacji reakcji z udziałem i bez udziału katalizatora zilustrowane sę na rys.1.2. Obniżenie energii aktywacji zwiększa liczbę częstek aktywnych, a więc i liczbę zderzeń efektywnych w układzie w danej temparaturze, co zwlęk< sza szybkość reakcji chemicznej.
Często czynnikiem ograniczającym szybkość reakcji chemicznej Jest szybkość dostarczania substratów do lub szybkość odprowadzania produktów z obszaru reakcji. W takich przypadkach czynnikami zwiększającymi szybkość reakcji jest mieszanie środowiska reakcji lub rozdrobnienie reagentów. Mieszanie 0026 być reeli* zowane za pomocę mieszadeł mechanicznych, barbotażu gazami lub działaniem ultradźwięków.
1.1.3.2. Równowaga chemiczna
Na ogół wszystkie reakcje chemiczne sę odwracalne, to znaczy z danych substratów tworzę się produkty, a Jednocześnie produkty reakcji ulegaję rozkładowi na substraty. Fakt ten w równaniach chemicznych często zaznaczamy dwoma przeciwnie skierowanymi strzałkami % *• . Reakcje nieodwracalne n-leżę do wyjętków i biegnę z reguły wtedy, gdy 1ed«n z produktów opuszcza środowisko reakcji. Rozpatrzmy cgolnę reakcję, w której a moll substancji A oraz b moli substancji B tworzy e moli substancji E i d moli substancji D
a A + b B
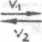
e E ♦ ć 0
(1 .23;
Szybkość v, przsmiany substratów w produkty będzie zgodnie z równaniem (1.17) opisana wzorem
Szybkość maleje w cza3ie trwania reakcji w miarę zmniejszania się stężania substratów A i B. 2 chwilę pojawienia się pierwszych ilości produktów £ i D może występie proces odwrotny, tj. produkty mogę ulegać przemianie 2 powrotem w substraty A i B z szybkościę v^.
Szybkość v2 tej odwrotnej przemiany będzie wynosiła

i będzie rosła w czasie trwania reakcji (1.23), wskutek nagromadzania się coraz większych ilości produktów £ i G. Zmiany stężeć substratów i produktów reakcji chemicznej w czasie jej trwania zilustrowane sę na rys.1.3.

Czas reakcji
Rys.1.3. Zmiany stężeń substratów i produktów w czasie biegu reakcji chemicznej
Gdy temperatura T reagujęcego układu Jest stała w czssie procesu, wtedy zmiany szybkości reakcji wprost i reakcji odwrotnej spowo-
23
Wyszukiwarka
Podobne podstrony:
Samsung SCX 6x22 Series 091118165128 1 6) Oak rozumiesz sten równowagi chemicznej
Samsung SCX 6x22 Series 091118164709 1 Oparzenia w przypadku lżejszych oparzeń skóry, wywołanych pło
Samsung SCX 6x22 Series 091118164751 1 informuje nas, że 1 mol węgla (2.2 g) reaguje z 1 molem tlenu
Samsung SCX 6x22 Series 091118164822 1 niania 1 r e d u k c J 1 , np. q a &n
Samsung SCX 6x22 Series 091118164846 1 wzrasta od 2 do 4 razy, co nożna zapisać wzorem W s kT + 10 •
Samsung SCX 6x22 Series 091118164934 1 ćowane sę Jedynie zmianami stężeń reagujących substancji. Po
img049 (41) oprowadzenie do techniki sieci neuronowych 43 Rys. 3.1. Zmiany współczynników wag w siec
Photo0011 Rys. 9.7. Zmiany wydajności w czasie przy regulacji poprzez okresowe zatrzymywanie i uruch
28 (206) Zmiany energii podczas biegu reakcji czas przebiegu reakcji Przebieg reakcji egzotermicznej
skanuj0017 (215) 2.3. Antropopresja w XX wieku - początek globalnej katastrofy biosfery? 41 Rys. 2.3
SNC03596 bądź rozprężanie) nie pociąga za sobą zmiany ciśnienia (a-b na rys. 5.2). Zmianyp; zności p
3-2015 TRIBOLOGIA 61 Rys. 3. Zmiany współczynnika tarcia badanych powłok podczas testu
POM Marszałek60 Si liipffi Rys. 8 Zmiany wartości długookresowego wskaźnika migotania śwtatePH w sta
naprawa V640 cz 2 Rys. Z Zmiany połączan rezystorów i diody w mułtimotrze V-640 stosunkowo łatwo i t
naprawa V640 cz 3 do zasilania Rys. 2. Zmiany połączeń rezystorów i diody w mifttimotrzo V-640 doWPO
więcej podobnych podstron