136
A HibUl. IM1U.1 ,Vvo r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >«}
136 4 BLDOWA CZĄSTECZKI
ora/<5-. równych co do wartości bezwzględnej elementarnemu ładunkowi elektrycznemu 0,16022 10 18 C. moment dipolowy wynosi
,t = 0,1602 lO-"* • 100 lO"'2 = 16.02 10"* C m
W praktyce momenty dipolowe są jednak najczęściej wyrażane w debajach, jednostkach układu CGS. oznaczanych symbolem D
1 D = 3.33564 10 W C m
Moment dipolowy 16.02 I0-3" C m odpowiada więc wartości 4.803 D.
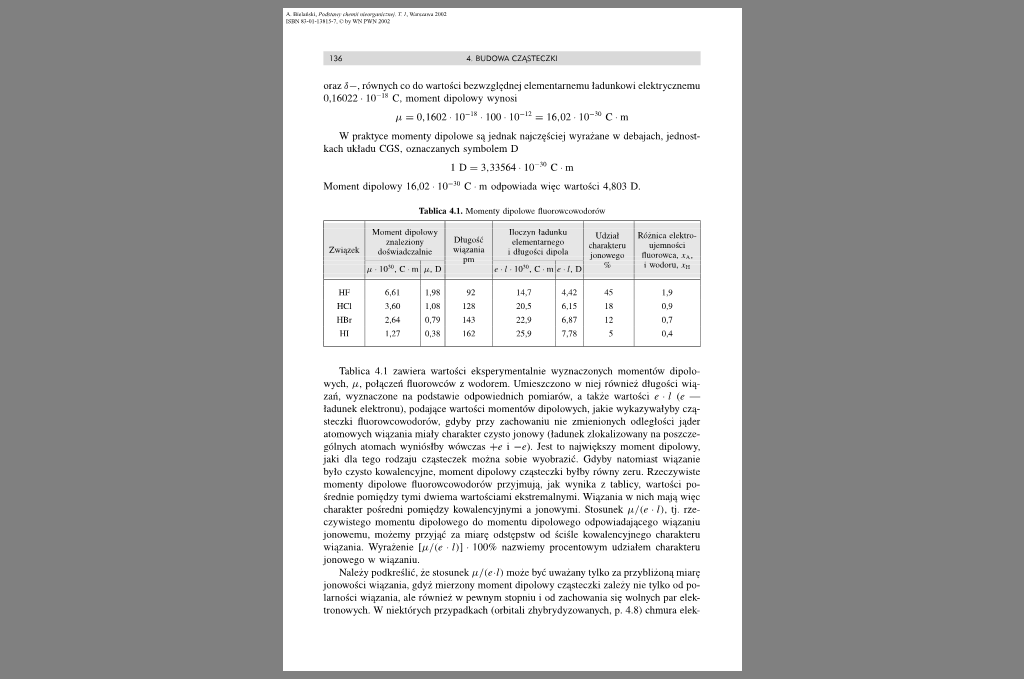
Tablica 4.1. Momenty dipolowe floołuweuwCHlułów
|
Związek |
Moment dipolowy aatattony doświadczalnie |
Dtagołił wiązania pm |
Iloczyn ładunku denwmarnego i długości dipolu |
Udział etumkteru jon tMc go ■a |
Różnica elckuo-ujemności fluotowtii. i wodoiu. m | ||
|
n IO*. C m |
D |
c l 10'°. C m |
c l. D | ||||
|
HF |
6.61 |
1,98 |
92 |
14.7 |
4.42 |
45 |
1.9 |
|
MCI |
3.60 |
l.OS |
128 |
20.5 |
6.15 |
18 |
0.9 |
|
lIBr |
2.64 |
0.79 |
143 |
22.9 |
6.87 |
12 |
0.7 |
|
III |
1.27 |
0.38 |
162 |
25.9 |
7.78 |
5 |
0.4 |
Tablica 4.1 zawiera wartości eksperymentalnie wyznaczonych momentów dipolo wych. fi. połączeń Huorowców z wodorem. Umieszczono w niej również długości wiązali, wyznaczone na podstawic odpowiednich pomiarów, a także wartości c l (e ładunek elektronu), podające wątłości momentów dipolowych, jakie wykazywałyby cząsteczki fluorowcowodorów. gdyby przy zachowaniu nie zmienionych odległości jąder atomowych wiązania miały charakter czysto jonowy (ładunek zlokalizowany na poszczególnych atomach wyniósłby wówczas +<• i -e). Jest to największy moment dipolowy, jaki dla tego rodzaju cząsteczek można sobie wyobrazić. Gdyby natomiast wiązanie było czysto kowalencyjne, moment dipolowy cząsteczki byłby równy zeru. Rzeczywiste momenty dipolowe fluorowcowodorów przyjmują, jak wynika z tablicy, wartości pośrednie pomiędzy tymi dwiema wartościami ekstremalnymi. Wiązania w nich mają więc charakter pośredni pomiędzy kowalencyjnymi a jonowymi. Stosunek n/(c ■ I). tj. rzeczywistego momentu dipolowego do momentu dipolowego odpowiadającego wiązaniu jonowemu, możemy przyjąć za miarę odstępstw od ściśle kowalencyjnego charakteru wiązania. Wyrażenie hif(c ■ /» ■ 100% nazwiemy procentowym udziałem charakteru jonowego w wiązaniu.
Należy podkreślić, ze stosunek n/(el) może być uważany tylko za przybliżoną nuarę jonowości w iązania, gdyż mierzony moment dipolowy cząsteczki zależy nie tylko od po-lamości wiązania, ale również w pewnym stopniu i od zachowania się wolnych par elektronowych W niektórych przypadkach (orbitali /hybrydyzowanych, p. 4.8) chmura elek
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vvo --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 11
A HibUl. IM1U.1 ,Vvo r.», r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 3.
A HibUl. IM1U.1 .Vvo r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 12 8 DI
S4 A HibUl. IM1U.1 ,Vvo r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS
S7 A HibUl. IM1U.1 ,Vvo --u, r ), buui :uO ISBN D4H1II S-7. © l>. WN TOS
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 337 11
A HibUl. IM1U.1 .Vvu r.., r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 34
A HibUl. IM1U.1 ,Vvu --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»i --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 1.3
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 10
A HibUl. IM1U.1 .Vv»i r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} I 5 ZA
więcej podobnych podstron