IMGX01 (4)

5 W molekułach nieliniowych wielkość A traci sens ze względu na wiele kierunków osi międzyjądrowych. Termy elektronowe określa się więc w stosunku do elementów symetrii molekuły za pomocą symboliki teorii grup opisanej w punkcie 3.4.7. Przy I odpowiednich symbolach A, B, E, F górny lewy indeks oznacza multipletowej I termu. Natomiast dolny prawy indeks oznacza symetryczność (g) lub antysyraetrycz. I ność (u) względem środka symetrii i symetryczność (1) lub antysymetryczność (2) względem osi symetrii o niższej krotności. W przypadku molekuł o więcej niż jednej 1 osi o najwyższej krotności (grupy punktowe D2, D2h) symbolika się nieco zmienia i za 9 pomocą indeksów 1,2, 3 numeruje się kolejne przypadki symetrii dość dowolnie. Dla 0 fermów trójkrotnie zdegenerowanych zamiast symbolu F stosuje się często symbol T. I
5.2. Energia stanów elektronowych
Energia potencjalna i kinetyczna elektronów w molekule zmienia się w czasie f oscylacji zrębów atomowych. W n-atomowej molekule mamy 3n — 6 (w liniową i 3n — 5) współrzędnych opisujących ruch zrębów atomowych względem siebie. Każdy [ stan elektronowy jest więc charakteryzowany przez biperpowierzchnię energii j potencjalnej w przestrzeni (3n — S)-wymiarowej w przypadku molekuły nieliniową i lub (3n — 4)-wymiarowej w przypadku molekuły liniowej. Jeżeli powierzchnia energii I potencjalnej ma minimum albo kilka minimów, to stan elektronowy opisywany tą | powierzchnią jest trwały. Jeżeli zaś na powierzchni energii potencjalnej nie nu i minimum, to stan elektronowy jest nietrwały (brak wiązania).
Powierzchnia energii potencjalnej molekuły dwuatomowej jest rozłożona w prze- [ strzeni (3n — 4)-wymiarowęj, czyli dwuwymiarowej. Jest więc właściwie nie po-1


Rys. S.5. Krzywe energii potencjalnej różnych u nów elektronowych molekuły Li2. Krzywa prany wana nie ma minimum i odpowiada odpychana r atomów, czyli stan jest nietrwały
wierzchnią, lecz dobrze znaną krzywą energii potencjalnej, którą omawiali®) w punkcie 3.2.ł (rys. 3.4). Na rysunku 5.5 przedstawiono krzywe energii potencjalną różnych stanów elektronowych molekuły Lia,
Tak proste molekuły jak trójatomowe liniowe mają powierzchnie entfp potencjalnej rozłożone w przestrzeni pięciowymiarowej. Można je przedstawić m wykresach przestrzeni trójwymiarowej tylko wtedy, gdy niektóre współrzędne będą potraktowane jako stałe. Zakładając np. że dwie współrzędne drgań zginający^ w liniowej molekule typu XYZ są stałe, możemy przedstawić w przybliżeniu 5,2 powierzchnię energii potencjalnej w zależności od zmian współrzędnych X-Y i Y-Z drgań tylko rozciągających w przestrzeni trójwymiarowej. Na rysunku 5.6 przedstawiono krzywe energii potencjalnej w różnych przekrojach powierzchni energii i dla różnych stanów elektronowych w molekule HCN. Element przestrzeni w kształcie prostopadłościanu jest przecięty dwiema płaszczyznami przechodzącymi
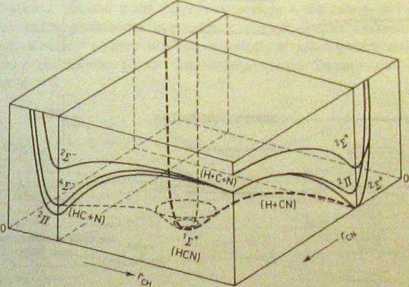
Rys. 5.6. Uproszczone przedstawienie niższych powicrzchni potencjalnych molekuły HCN. Założono brak drgań zginających, czyli Współrzędne tych drgań przyjęto za stale. Współrzędne ral i oznaczają zmiany odległości C-H i C-N w trakcie obu drgań rozciągających. Krzywe energii potencjalnej wyrysowane są na płaszczyznach przekrojów prostopądlościcnnej przestrzeni. Na wysokości prostopadłościanu odkładana jest energia (według G. Herzbcrg, „Mokcular Spectra and Mołecuiar Structurc. HI. Electronic Spectra and Electronic Structure of Polyatomic Molecules”; za zgodą Wydawnictwa Van Nostrand C&, New York 1966, rys. 170 na *. 441)
przez punkty na bokach podstawy odpowiadające odległościom C-H i C-N w stanie równowagi. Przecinanie się tych płaszczyzn z powierzchniami energii potencjalnej różnych stanów elektronowych wyznacza krzywe energii potencjalnej tych stanów jako funkcje tylko jednej współrzędnej |M lub r^. Już w takim wielkim uproszczeniu obraz jest mało czytelny, a przecież gdybyśmy zrezygnowali z przybliżeń zakładających stałość współrzędnych drgań, rysunek stałby się znacznie bardziej skomplikowany.
Trzeba podkreślić, że stosowane przybliżenia nie oddalają nas zbytnio od rzeczywistości. Ze względu bowiem na małą masę elektronów w porównaniu z masą jąder ruch elektronów jest znacznie szybszy niż oscylacje zrębów atomowych. Energia elektronów zmienia się tak szybko, że w tyra czasie położenia jąder nie zdążą się zmienić. Opisuje to zasada Francka-Condona: przejścia elektronowe w molekule odbywają się tak szybko w porównaniu z oscylacyjnym ruchem jąder, że wszystkie odległości międzyjądrowe można uznać za State w czasie przejścia elektronowego. Jednakże wykresy typu przedstawionego na rys, 5.6 są nieprzydatne i jeżeli śjg je rozpatruje, to w wybranych przekrojach w postaci krzywych energii potencjalnej.
Wyszukiwarka
Podobne podstrony:
zawarty w niej sens, ze względu na swoje znaczenie, na wartość wyrazu i z uwagi na związki duchowe i
skanuj0023 (84) 31 31 T /. kolei ze względu na .sposób przedstawianiu zależności między różnymi zjaw
administracyjnego. Jest rzeczą oczywistą, że ze względu na podstawowe różnice zachodzące między obom
31 Z kolei ze względu na sposób przedstawiania zależności między różnymi zjawiskami ekonomicznymi,
3. Podział PZ ze względu na wzajemne położenie osi: Przekładnie równoległe Przekładnie kątowe,
i funkcjonalne, [8]. Konstrukcje z drewna klejonego, ze względu na wiele zalet, zajmują tu ważne mie
Ze względu na zasięg i kierunek działalności stowarzyszeń i organizacji społecznych można
charakterystycznymi.... Ze względu na zakres i kierunek działania Ruchy reformatorskie: -
Skale behawioralne Tonowy typ skal zdobywających coraz większą popularność ze względu na wiele zalet
więcej podobnych podstron