P5101335
Zadanie 19 (1 punkt)
fWpnmdłono dr^wiad* /cnie. które można opisać skróconym równaniem jonowym
Bat*4 + S©,1' -Ą BaSO,
MBndlc tablicę rozpuszczalności, zaproponuj odczynniki, jakie można użyć celem przeprowadzenia tej reakcji, a następnie zapisz w formie cząsteczkowej jej przebieg.
OdpowMŻ:
Należy użyć np roztworu BaClz i NijSO,.
BaCI2 + Na,SO, -► BaSO^l + 2 NaCl
Zadanie 20 (1 punkt)
Czy wszystkie sole rozpuszczalne w wodzie ulegają hydrolizie? Odpowiedź uzasadnij odpowiednimi przykładami.
Odpowiedź:
Nie Hydrolizie nie ulegają sole pochodzące od mocnych zasad i mocnych kwasów, np. CaCL,, KCI, Nad.
Zadanie 21 (3 punkty)
NMępufeoe ilości sok. 0.5 mola Na< 1.28 g (aC I, i 0.75 mola NaNO, wprowadzono do kolby z wodą.uzyskując roztwói o objętości 2 dm*. (iporządkuj jony obecne w roztworze według malejącego ich stężenia molowego.
Odpowiedź:
1) NaCl -► Na* + C1‘
0,5 mola 0,5 mola 0,5 mola
2) mk
40 + 2 - 35,5 = 111 [g/moll
111 g CaCI2 - 1 mol
28 g CaCl2 - x
x = 0,25 mola CaCl2
CaClj 0,25 mola
♦ Ca2* 0,25 mola
+ 2C1-
2 • 0,25 mola
35
NaNO, 0,75 mola
Na* + NO," 0,75 mola 0,75 mola
Liczba moli jonów Na*: Liczba moli jonów Ca1*: Liczba moli jonów Cl : Liczba moU jonów NO,"
0,5 +0,75 = 1,25 0,25
0.5 + 2 • 0,25 = 1 0,75
w 2 dm* roztworu
1
2
- . m°l
0,5-1
dm’
|
tm |
0,25 * 2 |
mol = 0,125-r dm5 |
|
no;] |
0,75 2 |
mol = 0,375-r dm3 |
Szereg malejącego stężenia molowego jonów:
[Na*]>[ci ]>[NO;]>[Ca1*]
Zadanie 22 (3 punkty)
Uczniowie wykonali doświadczenie polegające na wprowadzeniu do probówek z wodą określonej Sośó tlenku, i w dalsze) kolejności - wykorzystując odpowiednie wskaźniki kwasowozasadowe - zbadano pH każdego z roztworów :
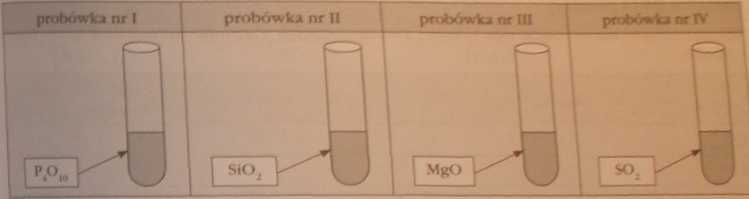
W które) probówce roztwór wykazał najwyższą wartość pH?
W której probówce roztwór wykazał pH < 7?
W której probówce pH roztworu wynosi 7?
Odpowiedź uzasadnij, pisząc dodatkowo odpowiednie równania reakcji.
Odpowiedź:
Probówka nr I: P.t010 + 6 HzO -► 4 H}P04
H P04 => w roztworze wodnym dysocjuje => jony H* => pH < 7
Probówka nr II: SiOz + HzO X*" nie zachodzi => pH = 7
Probówka nr ni: MgO + HzO -► Mg(OH)2
Mg(OH)2 => w roztworze wodnym dysocjuje => jony OH" => pH>
Probówka nr IV: S02 + H.O -- H2S03
HjSO, => w roztworze wodnym dysocjuje => jony H* => pH < 7
Roztwór wykazał najwyższą wartość pH w probówce nr HI.
Roztwór wykazał pH < 7 w probówce nr I i IV.
W probówce nr II pH roztworu wynosi 7.
Zadanie 23 (2 punkty)
Uczeń wykonał następujące doświadczenie: na białej kartce papieru napisał piórem zanurzonym w bezbarwnym roztworze węglanu potasu swoje imię: Mateusz. Po wysuszeniu kartki przetarł ją watą zwilżoną fenoloftaleiną, wskutek czego napis zmienił kolor na malinowy. Wyjaśnij przebieg tego doświadczenia, pisząc odpowiednie równania reakcji (forma uproszczona).
ROwnotragł w roztworach wodnych elektroHtów 137
Wyszukiwarka
Podobne podstrony:
P5101357 Zadanie 12(1 punkt) Czy prawdziwe jest stwierdzenie? Rodzaj materiału, z którego wykonana j
P5101314 Zadanie 30 (1 punkt) Akwopłs to zjawisko wympowinta chemicznego w dwóch l
34300 P5101350 Zadanie 19 (2 punkty) Sola równowagi reakcji odwracalnej H, + 1, «=* 2 HI w określone
81601 P5101318 p Zadanie 11 (1 punkt) Zaprojektuj doświadczenie pi (Mrzymyumnk wodorotlenku cbnmu(ll
P5101312 Zadanie 19 (2 punkty) ^HHtyMMMOMfc.któweu cekin fest oUzymanie chlorowodoru Opis doświadcze
P5101324 Zadani* 4 fi punkt) Jrilr aM*b - podaaradi poniżej - pozwolą ru wriEnr H
więcej podobnych podstron