skan0200 (2)

Kinetyka chemiczna 203
Szybkość reakcji
A
B
zgodnie z równaniem (5.1) wyraża się wzorem
dc
dt
gdzie c = cA.
Całkowanie tego wyrażenia dla odpowiedniego n prowadzi do równań kinetycznych przedstawiających aktualne stężenie substratu a w zależności od czasu t.
Oprócz stałej szybkości k oblicza się inny parametr - połówkowy czas reakcji /j/2, czyli okres, po którym stężenie substratu zmaleje dokładnie do połowy jego początkowej wartości, tm = t, gdy c = cy'2.
Szybkość reakcji rzędu zerowego (n = 0) nie zależy od stężenia:
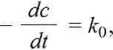
(5.2)
a scałkowanie tego równania przy warunkach początkowych t = 0, c = c\h daje wyrażenie
c = c0-k0t
lub
(5.3)
_go_ 2A'0 •
(5.4)
Szybkość reakcji rzędu pierwszego (« = 1) zależy od stężenia A według równania kinetycznego
dc
~dt
= A'! c,
(5.5)
•v którym c jest stężeniem A w chwili t. Całkowanie tego równania przy warunku początkowym t = 0, c = c0 prowadzi do wyrażenia
(5.6)
c = c0exp (-A-, t)
lub
k\ = — ln t
(5.7)
Wyszukiwarka
Podobne podstrony:
43071 skan0198 5. Kinetyka chemiczna Miarą szybkości reakcji w chwili / jest zmiana liczby moli któr
75540 skan0249 252 Kinetyka chemiczna 252 Kinetyka chemiczna Odp. k2 = 5a:9. Wyprowadzić równanie na
12447 skan0208 Kinetyka chemiczna 211 Rys. 5.1. Wyznaczanie rzędu i stałej szybkości reakcji metodą
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
kinetyka chemiczna 2 półczynniki dobierz metodą C) Napisz równanie reakcji, jaka zachodzi w obu nacz
więcej podobnych podstron