25020 skan0075

78 Termodynamika chemiczna
h
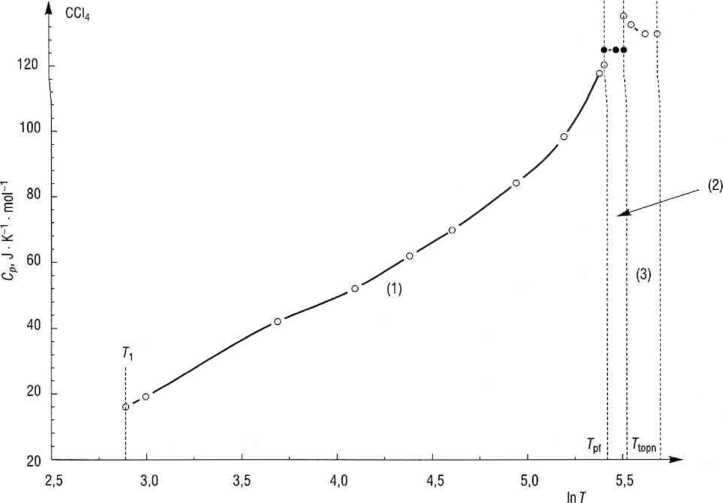
Rys. 3.13. Obliczanie z/S1, metodą trapezów - obszary całkowania i przemiany fazowe
w 240 K, toteż przyjęto, że jest ona siała w całym przedziale 225,4-250,2 K. Na rys. 3.13 te dodatkowe wartości pokazano ciemnymi punktami, a w tabeli zaznaczono je kursywą. P(i) jest powierzchnią z-/ego trapezu.
Do obliczenia zmiany entropii podczas obu przemian fazowych korzystamy z wyrażenia (3.52)
^Spf = AH°f/Tpf.
Wartości AS£f dla obu przemian zestawiono w tab. 3.4 i pokazano na rys. 3.14. Warto zwrócić uwagę na ponad dwukrotnie większą zmianę entropii przy przejściu do fazy plastycznej (AS3) w porównaniu ze zmianą entropii podczas topnienia (zawartość entropii w 298,15 K obliczymy z zależności
■S?98 = «So + E^,
i
gdzie, zgodnie z III zasadą termodynamiki, Sfi = 0. Tak więc &°98 = 217,8 J • K-1 • • mol-1.
Wartość tablicowa wynosi 214,4 J • K-ł • mol-1. Głównym źródłem błędów jest z pewnością brak punktów pomiarowych w pobliżu obu przemian fazowych.
Wyszukiwarka
Podobne podstrony:
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0079 (2) 82 Termodynamika chemiczna Ciepło reakcji w T= 323,15 K możemy obliczyć z prawa Kirchho
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
skan0109 112 Termodynamika chemiczna 3e:19. Obliczyć zmianę entropii w procesie izotermicznego rozpr
skan0115 118 Termodynamika chemiczna 3f: 13. Normalna temperatura topnienia benzenu wynosi 278,6 K.
74354 skan0089 92 Termodynamika chemiczna Tabela
więcej podobnych podstron