P5101347
Odpowtodz
wnłikla się gaz.
po dodanai MnO. do probówki zachodzi gwałtowna reakcja:
MoO, I
h,o2
Ikack mang*nml\' peta* rolę katalizatora.
O
I iiow W ab Bpi> lej reakcji. H.O. — ■' » HO + in \aL.A.. “
- ' ^*c*łr iwhik pa^j
tac ac w itakcjl twórz* s*c aoau«7 den. który pku bardzo rcakrrwm twórz*- czasn-« -»t-; .i_
Zadanie 4 (1 punkt)
lodzącej
PodaI pmtial (napisz równanie) reakcji zachodzącej bez udziału katalizatora oraz reakcji z jego iMtaiafc-m Wyjaśnij, jaką funkcję pełni katalizator w przemianach chemicznych.
lMfcrjł zachodząca bez udziału katalizatora:------------------..._________________________________
Reakcja zachodząca z udziałem katalizatora:-------------------------------------------------------------
Funkcja karali żarom —— ----------—........—.............—------
np.
Reakcja zachodząca bez udziału katalizatora. Mg + 2 Ha -- MgO, + H.T
Reakcja zachodząca z udziałem katalizatora: Mg + I, -► Mgl,
Funkcja katalizatora zwiększa szybkość reakcji chemicznej.
Zadanie 5 (1 punkt)
Zaproponuj wykres zmian energii substratów i produktów podczas egzotermicznej reakcji chemicznej (A * B = O w załrżnnści od czasu trwania reakcji. Na wykresie zaznacz energię aktywacji oraz AR
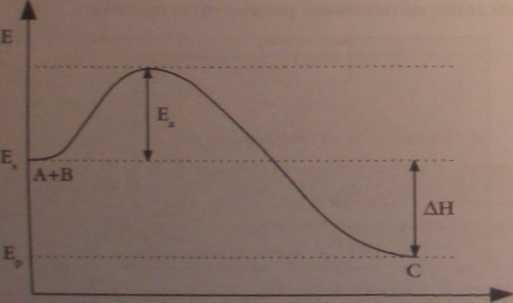
czas trwania reakcji
Zadanie 6 (1 punkt)

lipoponui wykres zmian energii substratów i produktów podczas cndotetmiczncj reakcji chemicznej « lakżności od czasu trwania reakcji, a następnie zmodyfikuj ten wykres, uwzględniając obecność kata-laaonw układzie reagującym.
Odpowiedź:
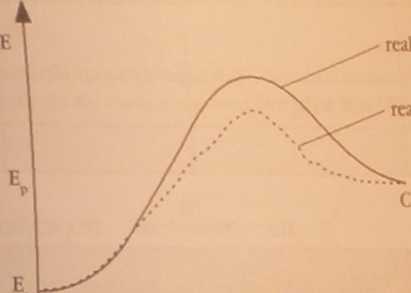
reakcja z udziałem katalizatora
A+B
reakcja bez katalizatora
czas trwania reakcji
Zadanie 7 (2 punkty)
.lak zmieni się szybkość reakcji tworzenia amoniaku: 3 H2 + N, = 2 NH, jeżeli ciśnienie zostanie zwiększone dwukrotnie? Równanie kinetyczne ma postać: v = k • [HJ’ • (N2j.
Odpowiedź:
v = k-[ąjJ-tN2]
zmiana ciśnienia -► zmiana objętości —► zmiana stężenia
•'MfcGĘp* 2i*y
f = iók- [n,j
r/r = l6
Szybkość reakcji wzrośnie 16-krotnie.
Zadanie 8 (2 punkty)
OHekdwinów należy zmniejszyć temperaturę układu, jeśli szybkość reakcji zmaleje 32-ktomie? Odpowiedź:
Należy skorzystać z reguły van ’t Hoffa:
— = ■fTm i założyć,że y=2 v.
— -z 32
- = -5 AT=-50
W
Temperaturę układu należy zmniejszyć o 50 K.

Wyszukiwarka
Podobne podstrony:
Do kogo się zwrócić po pomoc slide$ Do kogo się zwrocie po pomoc Jeśli masz kłopoty, pomocy możesz s
3 (1869) 3. W zbiorniku pod ciśnieniem pi=2.5-106 N/m2 znajduje się gaz o masie mi=2.5 kg. Do zbiorn
pielęgniarki przyczynił się, zwłaszcza po I wojnie światowej, do emancypacji kobiet. Dał im możliwoś
Lew słucha! uważnie, ale w odpowiedzi tylko się uśmiechnął. Po czym wrócił do kopania. Na pewno jest
termo5 Do reaktora uprowadza się 20 moli/min n-heksanu w temperaturze 450 K. Zachodz.i w nim reakcja
termo5 Do reaktora uprowadza się 20 moli/min n-heksanu w temperaturze 450 K. Zachodz.i w nim reakcja
Wnioski: Wydzielający się gaz to tlenek azotu(IV). Po ogrzaniu w probówce Pb(N03h otrzymujemy: PbfNO
Wnioski: Wydzielający się gaz to tlenek azotu(IV). Po ogrzaniu w probówce Pb(N03h otrzymujemy: PbfNO
skanuj0019 (94) *1 to już analogiczne do współczesnych ufnall. Wydaje się. że po raz pierwszy wprowa
gr b Imię i Nazwisko:Nr albumuOcena Dpunktów =Treść zadania Pkt W butli o objętość. V = 10 1 znajduj
histologia wykład�9 zlewanie sie ffuzja) błony komórkowej owocytu i plemnika Zaraz po wniknięciu p
więcej podobnych podstron