231 [1024x768]

238 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
które po uwzględnieniu (3.112) przyjmie postać
Nadmiar
ENTALPII
SWOBODNEJ
G* = RT{nx Inyt -t-n^nj/j)
(3.147)
Podobnie możemy otrzymać wyrażenia na inne termodynamiczne funkcje nadmiaru:
nadmiar entropii
SM = n^-ŚW+n^-Ś?)
Nadmiar
entropii
(3.148)
nadmiar entalpii
Nadmiar
entalpii
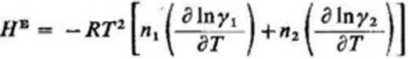
(3.149)
Termodynamiczne funkcje mieszania i nadmiaru stanowią podstawę dla termodynamicznej charakterystyki właściwości roztworów.
Wyszukiwarka
Podobne podstrony:
221 [1024x768] 228 PODSTAWY TERMODYNAMIKI CHEMICZNEJWspółczynnik aktywności. Stany standardowe Warto
223 [1024x768] 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 230 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Stany STA
225 [1024x768] 232 PODSTAWY TERMODYNAMIK! CHEMICZNEJ Jeżeli dla reakcji zachodzącej w układach rzecz
229 [1024x768] 236 PODSTAWY TERMODYNAMIKI CHEMICZNEJ znać wartości cząstkowych molowych funkcji term
233 [1024x768] 240 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Termin „roztwory pospolite” wyraża tutaj jedyni
239 [1024x768] 246 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 246 PODSTAWY TERMODYNAMIKI
241 [1024x768] 248 PODSTAWY TERMODYNAMIKI CHEMICZNEJEntropia a prawdopodobieństwo termodynamiczne Ja
243 [1024x768] 250 PODSTAWY TERMODYNAMIKI CHEMICZNEJ oraz wyrażeniem na energię wewnętrzną (3.170) I
245 [1024x768] 252 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 1. Traaslacyjna suma stanów. Aby obliczyć sumę
247 [1024x768] 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ wówczas: 254 PODSTAWY TERMODYNAMIKI CHEMICZNEJ
251 [1024x768] 258 PODSTAWY TERMODYNAMIKI CHEMICZNEJa stąd: R -in" ‘ i(3.212)Występujące w ty
253 [1024x768] 260 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Energię poziomów elektronowych tlenu przeliczam
255 [1024x768] 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ 262 PODSTAWY TERMODYNAMIKI CHEMICZNEJ Tak
257 [1024x768] 264 PODSTAWY TERMODYNAMIKI CHEMICZNEJ obliczyć standardową zmianę entalpii reakcji CH
249 [1024x768] PODSTAWY TERMODYNAMIKI CHEMICZNEJ Skąd InGrot = MnT+const Wstawiając tę wartość do ró
PODSTAWY TERMODYNAMIKI CHEMICZNEJ skrypt do wykładów Maria Bełtowska-Brzezinska Wydział Chemii U
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
81615 skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i s
więcej podobnych podstron