47935 Kwas zas1302

578 | Rozdzul 38IV U
CO, ♦ H20 2 H2C03 £ HC03- + H‘
Pr'
ti
H • Pr
Z tego powodu sam układ buforujący CO-j/HCOj" nie może przeciwdziałać zmianom pH wywołanym dodaniem C02.
b. Niedobór C02
(1) Jeżeli C02 zostanie usunięty z układu C02/HC03‘, to w roztworze znajdzie się mniej cząsteczek C02, które po połączeniu z wodą mogłyby wytworzyć jony HCO3-.
(2) W tych warunkach jest nie tylko mniej C02 w roztworze, ale również mniejsze są (H1J i IHCOj ), co powoduje, że reakcja przesuwa się w lewo.
c. Reguły. Stężenie kwasu dodanego do roztworu buforującego w formie C02 jest
równe zmianie [HC03']ł.
(1) Jeżeli C02 zostanie dodany łub usunięty z roztworu, to [H‘] i [HC03'] zmieniają się w takim samym kierunku, a pierwotne zaburzenie równowagi kwaso-wo-zasadowej ma charakter oddechowy.
(2) Jeżeli kierunek zmian (HC03'] jest przeciwny kierunkowi zmian pH, to pierwotnym zaburzeniem równowagi kwasowo-zasadowej jest zaburzenie oddechowe.
(3) Zależność między pH i (HC03 j przy różnych ciśnieniach cząstkowych C02 jest niemal linią prostą, zwaną linią buforową lub krzywą miareczkowania C02 (zob. ryc. 38-7).
d. Podsumowanie
(1) Nadmiar lub niedobór jonów H1 powoduje zmianę [H‘] i [HC03~] w przeciwnych kierunkach, a zaburzenie równowagi kwasowo-zasadowej ma charakter
metaboliczny.
(2) Nadmiar lub niedobór C02 powoduje zmianę JH1] i [HC03'j w tym samym kierunku, a zaburzenie równowagi kwasowo-zasadowej ma charakter oddechowy.
C-] Właściwości izobar ciśnienia cząstkowego C02 (Pco2)
1. Przy stałym |HC03] ciśnienie cząstkowe C02 jest proporcjonalne do [H1].
Tę zależność przedstawia następująca postać równania Hendersona odnosząca się do
Pco2 (zob. rozdz. 34 V):
|H1] = 24
Pco2
IHCO3T
Pco,.iH±aęM.
2. Przy stałym pH (tzn. wzdłuż jakiejkolwiek linii pionowej na ryc. 38-6 oraz 38-7) ciśnienie cząstkowe C02 jest proporcjonalne do |HC05'J.
0 INTERPRETACJA ZABURZEŃ RÓWNOWAGI KWASOWO-ZASADOWEJ ZA POMOCĄ DIAGRAMU pH-lHC03~] (ryc. 38-8). Zaburzenia równowagi kwasowo-zasadowej można określać metodą graficzną na podstawie punktów przecięcia izobar Pco2 dla 40 mm Hg z normalną linią buforu. Punkt przecięcia tych dwóch krzywych oznacza normę (N), dla której pH jest równe 7,4 (odcięta), a IHC03‘1 wynosi 24 mmol/1 (rzędna). Punkt N jest potrójnym punktem przecięcia, który określa pH, [HC031 oraz ciśnienie cząstkowe C02 osocza krwi tętniczej zdrowego człowieka.
[XI Punkty na lewo od punktu N (punkty A, C, E oraz F) wskazują kwasicę. Punkty na prawo od punktu N (punkty B, D, G oraz H) wskazują zasadowicę.
1. Odcinek NA przedstawia kierunek zmian w odpowiedzi na wzrost Pco2. Punkty na lewo od normalnej izobary Pco2 (punkty A, E oraz F) wskazują kwasicę oddechową.
a. Punkt A określa warunki nieskompensowanej kwasicy oddechowej, związanej z niską wartością pH, wysokim [HC03' J oraz wysokim ciśnieniem cząstkowym C02.
b. Punkt E oznacza kwasicę oddechową (T Pco2) połączoną z kwasicą metaboliczną U (HCOj j).
c. Punkt F oznacza kwasicę oddechową (T Pco2) w połączeniu z zasadowicą metaboliczną (T (HCOj-J).
2. Odcinek NB przedstawia kierunek zmian w odpowiedzi na obniżenie Pco2. Punkty na prawo od normalnej izobary Pco2 (punkty B, G oraz H) wskazują zasadowicę oddechową.
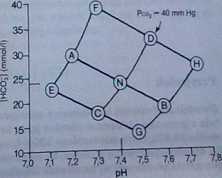
RYC 3&8. Zaburzenia równowagi kwasowo-zasadowej. [HCOj"l odnosi się do osocza. Odcinek ANB oznacza normalną Imię buforową, a odcinek CND normalną izobarę ciśnienia cząstkowego C02 (PcOj) (40 mm Hg). N - norma; A - kwasica oddechowa (nieskompensowana); B - zasa-dowica oddechowa (nieskompensowana); C -kwasica metaboliczna (nieskompensowana); D -zasadowica metaboliczna (nieskompensowana), E - kwasica oddechowa + kwasica metaboliczna; F - kwasica oddechowa + zasadowica metaboliczna; G - zasadowica oddechowa + kwasica me taboliczna; H - zasadowica oddechowa + zasadę wica metaboliczna. (Według: H.W. Davenport: The ABC ofAcid-Base Chemistry, wyd. 5. Chicago. Unn-ersity of Chicago Press, 1969, s. 65).
U człowieka stęieroe |HC03] w osoczu wynosi 24 « 10‘3 Eq/1(24 « 10° mol/l), natomiast stężenie (lf| jest równe 40 " 10 s E<j/J (40'10 9 mol/l). Tak więc |HCOj'| jest 6 1 101 większe niż |H‘l. talem przesunięcie równowagi (w prawo
lub w lewo) ma znacznie większy wpływ na (811 mi na |)iC03 ),
Wyszukiwarka
Podobne podstrony:
Kwas zas1302 578
Kwas zas1302 578
87997 Kwas zas1301 Pierwotne I wtórna zaburzenia równowagi kwatowMUidowej i 577 Konstrukcja diagramu
skanuj0014 CO2 podnosi się. Dokonywany jest dzięki temu zapis ilciei wydzielonego CO.?; ■S przewodno
PrepOrg II146 (2) 149 125. KWAS BENZOESOWY Sprawdziła: E. Salwińsko COOK + KOH ♦ 2MnO,j + H£0 ^ + 2K
więcej podobnych podstron