skan0020 (5)

Stany skupienia materii 23
T= 273,15 + 23,5 = 296,65 K, R = 8,314 J • mor1 • KT1.
Zatem
= 1,653 -10-4 kg (0,1653 g). ■
22,99 -10~3 • 745 • 1,01325 • 105 • 178,5 • 10~6 760 • 8,314 • (273,15 + 23,5)
Ciśnienie mieszaniny gazów p jest sumą ciśnień parcjalnych składników (prawo Daltona)
P = Y.Pn (2-10)
gdzie pj = Xjp, Xj zaś jest ułamkiem molowym składnika i w mieszaninie
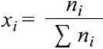
Przykład 2.2. W pewnej temperaturze, pod ciśnieniem 1 bara zmieszano po 1 dm3 H2, N2 i Ar. Obliczyć ciśnienia parcjalne gazów' w' mieszaninie.
Rozwiązanie. Zgodnie z hipotezą Avogadra dla T= const ip = const
~ ł7H2> *N2 ~ «N2 oraz ^Ar ~ nAx-
Ułamki molowe poszczególnych gazów wynoszą
__nu2_ _ ____L
Xli2 ~ «H2 + «N2 + nAr _ Vh2 + ^N2 + ^Ar 3 ’
•vH2 = *N2 = xAt = J >
a z prawa Daltona wynika, że
Ph2 = Pn2 = Pat ~ T ' 1 ~ T hara. ■
Oprócz izotermy (2.2), izobary (2.4) i izochory (2.6) definiuje się też adia-batę gazu idealnego. Odwracalną przemianę adiabatyczną takiego gazu opisuje
|
w'zór | ||
|
gdzie: |
pVK - const, |
(2.11) |
|
k = Cp!Cv |
(2.12) | |
|
oraz |
ypCy/R = conS|} |
(2.13) |
|
TcP/R/p = const. |
(2.14) |
Wyszukiwarka
Podobne podstrony:
skan0022 (6) Stany skupienia materii 25 skąd Stany skupienia materii 25 P . _ 2 • 105 8,314 • 300,7
skan0026 (3) Stany skupienia materii 29 Zatem dla gazowego argonu B = j -75,2 = 25,06 cm3 mol"1
skan0032 (3) Stany skupienia materii 35 i jest proporcjonalna do temperatury absolutnejpV = j MiP- =
skan0036 (3) Stany skupienia materii 39 gdzie M oznacza masę cząsteczkową (kg • mol-1), a - napięcie
więcej podobnych podstron