5806256266
Część III: Termodynamika układów biologicznych
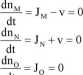
dt
Na uwagę zasługuje fakt, że występowanie sprzężenia nie ma wpływu na wartość i kierunek strumieni. Wyznaczmy teraz różnice potencjałów chemicznych poszczególnych substancji w stanie stacjonarnym:
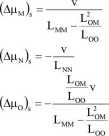
Rzuca się w oczy, że w układzie ze sprzężeniem strumieni występuje różnica potencjału chemicznego substancji O i to pomimo zerowego strumienia tej substancji. Różnica potencjału chemicznego substancji N nie uległa zmianie, a substancji M uległa zwiększeniu (mniejszy mianownik ułamka).
Entropia w stanie stacjonarnym
Przypomnijmy: stan stacjonarny to stan układu niezmienny w czasie, w którym układ produkuje entropię w tempie a, ale entropia układu nie ulega zmianie: dS/dt = 0. Można wykazać, że stan taki jest możliwy tylko wtedy, gdy strumienie i siły są stałe w czasie:
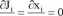
dt dt
Przy czym niektóre z nich mogą być równe 0, a reszta przyjmuje niezerowe, chociaż stałe wartości. W zależności od liczby niezerowych strumieni mamy stany stacjonarne odpowiednich rzędów: rząd 0 : wszystkie strumienie zanikają, a = 0 czyli układ nie wytwarza entropii, równowaga termodynamiczna,
rząd > 0: dodatnia szybkość produkcji entropii.
Na przełomie lat 50 i 60 XXw. Prigogine wykazał, że w stanie stacjonarnym układu produkcja entropii osiąga minimum lokalne. Oznacza to m.in., że układ samorzutnie wraca do stanu stacjonarnego po niewielkich odchyleniach.
Poprawność tego wniosku ograniczona jest tylko do najbliższego otoczenia minimum. Wynika to z kilku istotnych powodów:
■ definicja funkcji dyssypacji w podanej powyżej formie jest poprawna jedynie dla stanów niezbyt odległych od stanu równowagi. Jaka jest postać tej funkcji w znacznej odległości od stanu równowagi nie zostało w przypadku ogólnym wykazane.
16
Wyszukiwarka
Podobne podstrony:
Część III: Termodynamika układów biologicznych układu na jednym poziomie może być traktowany jako ca
Część III: Termodynamika układów biologicznych Materiały Pomocnicze do Wykładów z Podstaw
Część III: Termodynamika układów biologicznych ■ AG > O - reakcja przebiega spontanicznie, ale w
Część III: Termodynamika układów biologicznych 2N2 + 502 + 2H20 = 4H+ + 4N03 Standardowa zmiana ent
Część III: Termodynamika układów biologicznych Do opisu wymiany entropii z otoczeniem wygodnie jest
Część III: Termodynamika układów biologicznych Ldv - współczynnik ultrafiltracji lub osmozy Z faktu
Część III: Termodynamika układów biologicznych ■ przyjęliśmy liniową
Część III: Termodynamika układów biologicznychPOMIARY KALORYMETRYCZNEWstęp Pomiary kalorymetryczne
Część III: Termodynamika układów biologicznych niższej niż zadana temperatura doświadczenia T°,
Część III: Termodynamika układów biologicznych roztworu składnika B i proces się powtarza. W miarę j
Część III: Termodynamika układów biologicznych gdzie L, M, N są pochodnymi cząstkowymi funkcji g
Część III: Termodynamika układów biologicznych Tak więc objętość jest funkcją stanu gazu
Część III: Termodynamika układów biologicznych układach biologicznych. Od tego czasu badania takie
Część III: Termodynamika układów biologicznych r - współrzędna pracy. Należy teraz dla każdego
Część III: Termodynamika układów biologicznych ■ energia swobodna (F) zwana także
Część III: Termodynamika układów biologicznych dH = TdS - Vdp + Pidiij + pjdn } Jeżeli założymy, że
Część III: Termodynamika układów biologicznych fj.i = H-RTlnrij lub m = +
więcej podobnych podstron