skan0048 (2)

Termodynamika chemiczna 51
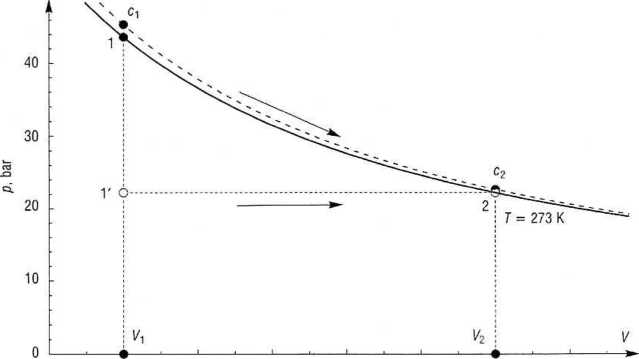
Rys. 3.1. Praca izotermiczncgo rozprężania gazu
Wstawiając wartości liczbowe, należy zwrócić uwagę na to, że wyrażenie w nawiasach musi być bezwymiarowe (toteż V = 1000 cm3), podobnie zresztą^ jak w równaniu (3.3a). Wstawiając obliczone ciśnienie do równania (3.3b), otrzymujemy wartość wykonanej pracy
W =-22,23 • 105 (1000 - 500) • 10“6 = -1111,5 J.
Na rys. 3.1 pracę tę przedstawia pole prostokąta VrV-2-V2. Wyraźnie widać, że praca zależy od sposobu przeprowadzenia przemiany.
Układ jest termostatowany - po dojściu do V2 jego stan końcowy jest więc :aki sam jak po przemianie odwracalnej. W obu przypadkach zmiana energii wewnętrznej jest jednakowa. Oznacza to, że również ilość ciepła wymienionego z otoczeniem (termostatem) zależy od drogi przemiany.
c) Jeżeli argon potraktować jak gaz idealny, to odwracalna praca rozprężania wyniesie
V2 1000
W=-nRT ln -y = -1 -8,314-273 ln = -1573,25 J.
Przemianę tę na rysunku pokazuje linia przerywana, a samą pracę - pole J]-crc2-V2. Jak widać, odstępstwo argonu od zachowania idealnego jest rzeczywiście niewielkie. ■
Entalpia H jest termodynamiczną funkcją stanu stosowaną w procesach izo-barycznych
(3.6)
H= U + pV.
Wyszukiwarka
Podobne podstrony:
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
skan0064 (2) Termodynamika chemiczna 67 3,33 3,34 3,35 3,36 3,37 1000/7 Rys. 3.7 I
skan0046 (2) 3. Termodynamika chemiczna I zasada termodynamiki stwierdza, że energia wewnętrzna U uk
skan0084 Termodynamika chemiczna 87 Ostatecznie otrzymujemy AG°(T) = -280,14 • 103 + 2,730r+ 13,72 T
22460 skan0054 Termodynamika chemiczna 57We = n CydT. (3.24) Pracę gazu idealnego
skan0050 (3) Termodynamika chemiczna 53 raz definicjami (2.15) i (2.16) 1 I dV V dT n a = :amy C„ -
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0060 Termodynamika chemiczna 63 Gdy to założenie nie jest spełnione, to do powyższej sumy należy
skan0062 Termodynamika chemiczna 65 ;_-_ eśla zależność między temperaturą T a ciśnieniemp w punkcie
skan0068 Termodynamika chemiczna 71 ze sprawność urządzenia jest zawsze wielkością dodatnią, a zatem
skan0074 Termodynamika chemiczna 77 Wartość entropii molowej CC14 w T2 = 298,15 K obliczymy z równan
41584 skan0070 Termodynamika chemiczna 73 Analogicznie dla entalpii dH(T, p) dH(p, T) = (4^ dp + (-
więcej podobnych podstron