33832 skanuj0027 (12)

Jeżeli AKT ulega hydrolizie w roztworze buforowym (IM NH4CI i 0,IM NHj), to możemy oszacować stężenie molowe powstających jonów S2":
[S2_] a 10'23 + 2823 = 10"*-3 a 3 10'7 M Zwróćmy uwagę na wartość ilorazu:
ęk.Ł!£M„3.,o'>
|S!'W 'O M
Przejście od roztworu o pH = 0,5 do roztworu o pH = 8,25, spowodowało wzrost stężenia jonów S2" aż o 15 rzędów wielkości.
Możemy zadać pytanie: dlaczego stosujemy środowisko o 8<pH< 8,5, a nie jeszcze bardziej alkaliczne (powstałoby dużo więcej jonów S2")? Kierujemy się tutaj własnościami jonu Mg2*. Jony S2 nie wytrącają go, ale jony HO" i CO32" mogą to uczynić:
• białe osady
Mg2* + 2 HO" £ Mg(OHT lub w obecności jonów C032' :
2 Mg2* + 2 HO" + C032' 2 (MeOHbCOi
Aby tego uniknąć, musimy utrzymywać niezbyt wysokie stężenie jonów
HO".
Jeżeli w warunkach strącania 3 grupy kationów, stężenie molowe jonów Mg2* wynosi » 0.1M, a iloczyn rozpuszczalności Mg(OH)2 ma wartość około 2TO"", to możemy wyznaczyć graniczną wartość pH, po przekroczeniu której, zacznie wytrącać się Mg£OH)2:
K„=2TO-" = [Mg2,][HO-]2 [Mg2*] = 0,1M
— = 210~'° czyli
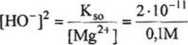
Obliczamy:
[HO"] = 1,4 10 5 M czyli pOH = 4,85
pH = {14-4.85) = 9,15 =9,2
Jak widzimy, w roztworach o pH > 9,2 możliwe jest wytrącenie się osadu MgfOHK Grozi to niemożnością wykrycia jonów Mg2ł w analizie 5 grupy, gdyby wytrąciły się wcześniej, razem z kationami 3 grupy.
Zbyt znacznej zasadowości roztworu zapobiega obecność odpowiedniego stężenia jonów NH4+:
NH3 + H20 [<"]
pamiętajmy, że- Kb = const
Roztwór NH4CI tak skutecznie obniża stężenie jonów HO", że iloczyny rozpuszczalności MgfOH)-. i (MgOHhCO; nie zostają przekroczone. Takie działanie jonów NHL/, dotyczy też innych wodorotlenków o stosunkowo dużych iloczynach rozpuszczalności, jak np: Fe(OHV> lub Mn(OH)%
Obecność mocnego elektrolitu, jakim jest NH4C1, sprzyja także koagulacji koloidalnych siarczków i wodorotlenków. Zapobiegamy w ten sposób „ucieczce” osadu koloidalnego do roztworu czyli peptyzacji.
Zawarty w roztworze buforowym NH3aq, zmniejsza protolizę jonów S2":
S2" + NH/ + H20 £ HS" + NH3aq
[*] [*]
Tworzenie się jonów HS', powoduje ubytek stężenia jonów S2", a do tego nie chcemy dopuścić.
53
Wyszukiwarka
Podobne podstrony:
skanuj0027 Jeżeli AKT ulega hydrolizie w roztworze buforowym (IM NH4CI i 0,IM NUj), to możemy oszaco
scan0019 s Oblicz stalą dysocjacji słabego kwasu jednoprotonowego, jeżeli pH spor/ądzonych roztworów
bufory1 Zadania rachunkowe do tematu hydroliza i roztwory buforowe 1. Napisz reakc
Wykład IV Hydroliza, roztwory buforowe
Podstawy teorii kwasów i zasad. Hydroliza. Roztwory buforowe. Koloidy. Podstawy chemii ciała stałego
kolos na mauila Zestaw A 1. Oszacować stężenie molowe jonów rtęci(ll) w 0,1 M rozt
skanuj0077 (12) ISO S. Mwo—
43976 skanuj0126 (12) 232 8. Cieślar6:5; Sprawdzić wytrzymałość drewnianej belki (rys. 6.5.1), jeżel
skanuj0004 12. Wartość pH roztworu mieszaniny kwasu kationowego glicyny z jej jonem obojnaczym w sto
więcej podobnych podstron